LA CÉLULA: UNIDAD FUNCIONAL
A pesar de su reducido tamaño, las células realizan todas las funciones
características de los seres vivos: se
nutren, captan estímulos y responden a
ellos, se autorregulan y se
reproducen. Algunas además,
fabrican alimentos, de los cuales
se nutren y a la vez éstos se convierten en alimentos para otras células.
Células y fotosíntesis:
Las células, como todo ser vivo necesitan consumir
alimentos, muchas no lo fabrican y deben
obtenerlos del medio. Otras, como las vegetales, las de las cianobacterias (organismos
procarióticos) y las de algunos
protistas, desarrollaron la capacidad de
fabricar alimentos por medio de la fotosíntesis.
La fotosíntesis es el
proceso mediante el cual las células vegetales,
las algas y las cianobacterias convierten la energía
lumínica
proveniente
del Sol en energía química, mediante la síntesis o fabricación de
compuestos orgánicos, como azúcares y
almidones. En las células eucarióticas
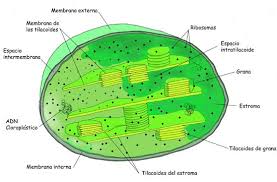
la fotosíntesis tiene lugar en el cloroplasto.
Este organelo está rodeado por una membrana doble. La membrana interna contiene una sustancia
semilíquida, de apariencia similar a la
clara de huevo, llamada estroma. Dentro del estroma se
encuentran unos sacos membranosos de color verde, similares a monedas, colocados o apilados unos sobre los
otros. Cada saco se denomina tilacoide
y
cada pila de ellos se denomina grana.
Las membranas de los tilacoides contienen el pigmento verde, llamado clorofila y pigmentos de otros
colores.
Durante la fotosíntesis la clorofila
de los tilacoides capta la energía de la luz solar y la envía a otros
tilacoides. Estos envían la energía
hasta el estroma. Allí, se encuentra toda la maquinaria necesaria
para utilizar esta energía en la síntesis o fabricación de dos sustancias o
moléculas que son portadoras de energía:
el ATP y el NADPH. Como
consecuencia de etas actividades, las
moléculas de agua que se encuentran dentro del estroma se rompen, fenómeno conocido como fotólisis. Este rompimiento hace que se libere
oxígeno, el cual puede ser utilizado por
la misma célula durante la respiración o puede ser liberado a la
atmósfera. A esta parte del proceso se
le denomina Fase clara de la fotosíntesis, porque se necesita la luz solar para que se
lleve a cabo.
El ATP y el NADPH sintetizados durante
la fase clara están disueltos en el estroma.
Allí suministran la energía para permitir la síntesis o fabricación del
azúcar simple, llamado glucosa, utilizando como materia prima dióxido de
carbono y agua. A esta parte del proceso
se le denomina Fase oscura de la fotosíntesis, porque no se requiere luz solar para que ocurra.
Los azúcares obtenidos durante la
fotosíntesis son enviados a los lugares de la cédula donde se necesitan. Si no se utilizan inmediatamente pueden
permanecer en el cloroplasto, donde se
convierten en almidón. También pueden
ser conducidos a otras partes de las células para elaborar productos más complejos, como ácidos grasos y celulosa.
Las células
se nutren
Todas las células necesitan alimentarse. Los alimentos contienen los nutrientes que
suministran a las células la energía necesaria para realizar todas sus
actividades vitales, reparar las partes
celulares que se encuentran deterioradas y llevar a cabo la división celular.
Para nutrirse, las células toman alimentos del medio y los
digieren liberando los nutrientes que contienen. Luego transportan esos nutrientes hasta los
sitios en los que se necesitan. Allí son
almacenados o se utilizan, y
finalmente, expulsan las sustancias de
desecho que se producen como resultado de la gran cantidad de reacciones
químicas que ocurren en su interior y que en conjunto reciben el nombre de metabolismo
celular.
La membrana
celular
La membrana celular tiene propiedades
selectivas. Es decir, deja pasar ciertas sustancias hacia el
interior de la célula e impide la salida de otras. Las células permiten el paso de agua y
alimentos a través de la membrana celular utilizando diversos procesos. Los más comunes son la difusión, la difusión facilitada, la ósmosis,
el transporte activo y la endocitosis.
Difusión. Si dejas caer una gota de tinta sobre agua
contenida en un vaso, puedes apreciar el
fenómeno llamado difusión. Notarás que
las partículas que se encontraban concentradas en la gota, poco a poco se empiezan a desprender y a
distribuir en toda el agua contenida en el vaso. Las partículas viajan de una región de mayor
concentración, que es la gota, a una
región de menor concentración, que es el
agua. Este movimiento continua, hasta eliminar la diferencia de
concentraciones. La difusión es
entonces, el paso de una sustancia desde
un sitio de mayor concentración, hasta
un sitio de menor concentración.
En las células, las sustancias se difunden a través de la
capa de lípidos de la membrana celular o a través de poros. Para que una sustancia se difunda hacia el
interior de una célula, la sustancia
debe estar en concentración más elevada fuera de la célula y la membrana debe
ser permeable a la sustancia. El
agua, el oxígeno y el dióxido de carbono
se difunden a través de las membranas celulares.
Difusión
facilitada. La mayoría de sustancias
que se disuelven en el agua no se pueden mover a través de la capa de lípidos
que componen la membrana celular. Estas
sustancias lograr atravesar la membrana gracias a la ayuda de proteínas
ubicadas en ellas, llamadas proteínas de
canal y transportadoras. Las proteínas
de canal forman túneles o canales a través de los cuales estas sustancias
pueden pasar. Las proteínas
transportadoras se unen a las sustancias que ingresan y esta unión ocasiona
deformaciones de la proteína, haciendo
que la sustancia que ingresa, penetre
por la parte central de la proteína.
Osmosis. Es la difusión de agua a través de una
membrana que tiene permeabilidad diferencial.
Esto significa que es más permeable al agua que a las demás
sustancias. Este tipo particular de
difusión está influido por la concentración de las partículas que se encuentran
disueltas en el agua.
Imagina que una célula se encuentra
suspendida en el agua. Si analizamos la
composición del agua en la que se encuentra suspendida la celula y de los
líquidos que se encuentran dentro de la célula,
podemos notar que en ellos se encuentran disueltas muchas sales. ¿Qué ocurre cuando dentro o fuera de las
células hay mayor o menor cantidad de
sales? ¿Estas condiciones tendrán algún
efecto en las células vivas? Veamos.
·
Las
células en soluciones hipotónicas se hinchan.
Recuerda que toda el agua, incluso la que compras a diario para beber,
tiene sales disueltas; sin embargo, su concentración es muy baja y por ello no
las alcanzas a percibir.
Imagina una célula viviendo en agua
dulce, como la que bebes a diario. Si bajo estas condiciones se compara el
líquido que se encuentra dentro de la célula con el que está fuera de
ella, se puede notar que la
concentración de sales del medio es menor que la del interior celular. Bajo estas condiciones se afirma que el medio
es hipotónico con respecto a la célula.
Como existe una baja concentración de
sales en el medio, en comparación con la
elevada concentración de sales dentro de la célula el agua tiende a entrar a la
célula, tratándose así de anular la
diferencia de concentraciones. Como
consecuencia de ello, la célula se
hincha. Este fenómeno se conoce como turgencia. Si no existiera un mecanismo de control de
salida de agua, la célula podría
explotar.
·
Las
células en soluciones hipertónicas se encogen.
Imagina ahora una célula viviendo en el mar. Para esta célula, la concentración de sales del medio es mayor
que la que existe dentro de su citoplasma.
Cuando el medio posee mayor cantidad de sales que la célula, se afirma que éste es hipertónico con respecto a la célula. En estas condiciones, el agua tiende a salir de la célula, tratando de equilibrar la concentración de
sales a ambos lados de la membrana .
Entonces, la célula se encoge o
arruga, disminuyendo su volumen.
·
La apariencia de las células en soluciones
isotónicas no cambia. Si se coloca una
célula en un medio que contiene igual concentración de sales dentro y fuera de
la membrana, se afirma que el medio es isotónico
con respecto a la célula. En estas condiciones no hay movimiento neto
de agua hacia adentro o afuera de la célula y la apariencia de la célula no
cambia.
Transporte
activo. Gran parte de las células
necesitan introducir a su citoplasma nutrientes que están en menor
concentración en el medio, que dentro de
ellas. Las células han desarrollado un
mecanismo para hacerlo. Ese mecanismo se
llama transporte activo y para ponerlo en funcionamiento la célula debe
invertir energía.
El transporte activo utiliza como
vehículo a las proteínas presentes en su membrana celular. Estas proteínas tienen dos sitios
activos: a uno de ellos se une la
sustancia que se va a transportar y al otro se une la molécula portadora de
energía, que generalmente es el ATP o
adenosintrifosfato.
Este mecanismo de transporte se pone
en funcionamiento cuando el ATP aporta energía a la proteína. La energía ocasiona que la proteína cambie
momentáneamente de forma, construyendo
una especie de canal que transporta la
sustancia hasta el interior de la
célula.
Endocitosis. Las células pueden ingerir o incorporar a su
citoplasma partículas grandes, sólidas o
líquidas mediante endocitosis. Para
llevar a cabo este proceso, las células
envuelven o engloban la partícula con su membrana celular. Entonces,
se forma una bolsa membranosa llamada vesícula, en cuyo interior se encuentra la sustancia
incorporada, que luego será vertida al
citoplasma.
Existen tres tipos de endocitosis que
son la fagocitosis, la pinocitosis y la endocitosis mediada por un receptor
específico.
·
La fagocitosis
es la captura de partículas sólidas. En organismos unicelulares generalmente las
partículas o seres atrapados por el proceso de fagocitosis buscan satisfacer la
necesidad de alimento del individuo. En
organismos pluricelulares, en
cambio, la fagocitosis es un mecanismo
de defensa y de protección. Los glóbulos
blancos de tu sangre, por ejemplo, protegen al cuerpo de microorganismos que
ingresan a él, fagocitándolos. Igualmente,
estas células sanguíneas de tu
cuerpo, fagocitan a tus propias células
dañadas, a tus glóbulos rojos que han
envejecido y a cualquier sustancia extraña que encuentren en su recorrido.
· La
pinocitosis es la captura de sustancias líquidas que la membrana no reconoce.
· La
Endocitosis mediada
por un receptor específico es un
mecanismo que utilizan las células para capturar sustancias concretas, que pueden estar presentes en bajas
concentraciones en el medio. La mayor
parte de las células poseen numerosos receptores utilizan las células para
capturar sustancias concretas, que
pueden estar presentes en bajas concentraciones en el medio. La mayor parte de las células poseen
numerosos receptores ubicados en la superficie externa de sus membranas
celulares. Cada receptor es un punto de
unión para un tipo de nutriente particular.
Estos receptores generalmente se acumulan en pequeños orificios de la
membrana celular, llamados fosas
cubiertas. Si el nutriente adecuado se
pone en contacto con el receptor, se introduce
en la fosa y se hunde cada vez más hasta penetrar en el citoplasma, formando una vesícula cubierta.








